Jean-Marie Ghuysen
Le secret de fabrication de l’armure des bactéries
Jean-Marie Ghuysen a passé la grande majorité de sa carrière de chercheur à étudier la paroi des bactéries et les interactions que celle-ci pouvait avoir avec certains antibiotiques. Dans une étude publiée dans Science en 1967, il révèle la structure de la paroi bactérienne.
Connaître son ennemi pour mieux le combattre. Cela aurait pu être la devise de Jean-Marie Ghuysen. Non pas pour aller au front combattre un ennemi de chair et d’os, mais pour lutter contre de minuscules mais impitoyables envahisseurs : les bactéries.
Pas évident de cerner un ennemi si différent de nous et invisible à l’œil nu ! « Dans les années 50’, après avoir travaillé pour une compagnie pharmaceutique, Jean-Marie Ghuysen revient à l’Université de Liège, au sein du service de bactériologie de la faculté de médecine », indique Jean-Marie Frère, professeur émérite de l’Université de Liège, et spécialiste de la résistance bactérienne. « A cette époque, on savait que les bactéries avaient besoin d’une armure pour se protéger de leur propre pression osmotique », poursuit Jean-Marie Frère. En effet, la membrane des bactéries étant très perméable à l’eau, ces microorganismes éclateraient sous la pression de l’eau qui y entrerait pour en diluer le contenu sans la présence d’une structure rigide, la paroi bactérienne. « Les scientifiques connaissaient donc l’existence de cette armure, responsable de la stabilité mécanique de la cellule bactérienne et qui peut-être comparée à un treillis à trois dimensions. Ils savaient aussi que la pénicilline empêchait la formation de ce treillis ». « D’autre part, le prédécesseur de Jean-Marie Ghuysen avait découvert une série d’extraits de bactérie capables de lyser d’autres bactéries », poursuit le Professeur. « Il s’agit de l’actinomycétine, un mélange d’enzymes secrétées par des bactéries du genre Streptomyces », précise le scientifique.
Une armure de sucres et de peptides
De retour dans le monde de la recherche, Jean-Marie Ghuysen était bien décidé à avancer dans la lutte contre les bactéries. Il a alors l’ambition d’élucider la structure de la paroi de ces dernières afin de mettre en évidence les éléments à cibler pour pulvériser cette armure. « Il voulait utiliser les enzymes secrétées par les Streptomyces et s’est donc lancé dans l’isolement de celles-ci, dans la caractérisation de leur activité et des conséquences de leurs interactions avec la paroi des bactéries », souligne Jean-Marie Frère. Cette démarche lui a permis de proposer, grâce aux moyens de l’époque, un modèle pour la structure de cette paroi, constituée d’un polymère qu’il appellera « peptidoglycane ». Mais aussi de cerner l’action d’enzymes bactériolytiques qui permettent de le détruire. « Dans ces années-là, la méthode utilisée était principalement la chromatographie sur colonne pour isoler des quantités aussi importantes que possible de morceaux de la paroi », explique Jean-Marie Frère. « On peut isoler le peptidoclycane des bactéries en les faisant bouillir avec du détergent. Tout est alors dissous sauf le peptidoglycane ». A partir de là, Jean-Marie Ghuysen faisait agir les différentes enzymes bactériolytiques et essayait de séparer les morceaux de peptidoglycane sur base de leur taille ou sur base de leur charge. « Ensuite ces morceaux étaient redécoupés grâce à l’utilisation de procédés chimiques pour obtenir de tout petits morceaux de la paroi bactérienne qui pouvaient être identifiés après chromatographie sur papier », continue le Professeur. C’est ainsi que Jean-Marie Ghuysen découvrit que la paroi des bactéries est composée de sucres et d’acides aminés.
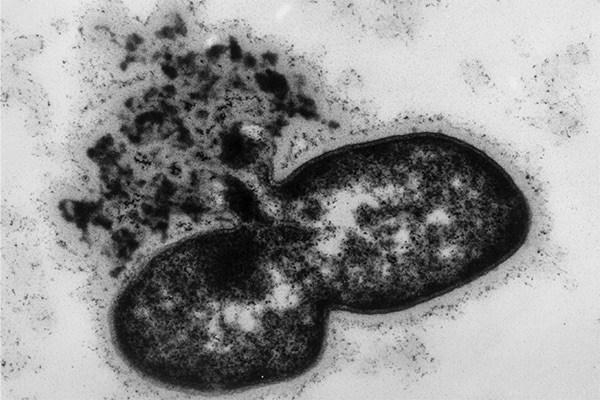
En absence de pontage du peptidoglycane, l’armure est inefficace et la bactérie explose !
Création d’une équipe pluridisciplinaire de choc
Au gré de ses analyses, Jean-Marie Ghuysen put confirmer que ce sont bien des sucres et des acides aminés qui composent la paroi de toutes les bactéries. « Avec quelques variations selon le type de bactéries mais des variations mineures », indique Jean-Marie Frère. « La paroi des bactéries est composée de chaînes linéaires de sucres entre lesquelles se forment des ponts composés de peptides de 6 à 14 acides aminés. Les différences principales observées d’une bactérie à l’autre se situent au niveau des peptides, de la façon dont les chaînes de sucre sont reliées entre elles ». Ces travaux majeurs ont été publiés en 1967 dans la prestigieuse revue Science(1). Suite à cette découverte capitale, Jean-Marie Ghuysen met sur pied une équipe pluridisciplinaire dont l’ambition est de comprendre, à l’échelle atomique, comment la pénicilline tue les bactéries. « C’est de la création de cette équipe qu’a découlé par la suite, après le départ de Jean-Marie Ghuysen à la retraite, le Centre d’Ingénierie des Protéines », souligne Jean-Marie Frère. Composée de spécialistes en biologie moléculaire, biochimie, génie génétique, chimie des protéines, enzymologie, radiocristallographie et autres disciplines spécifiques, cette équipe va tenter plus particulièrement de comprendre au niveau fondamental la structure et le mécanisme catalytique des enzymes responsables de la synthèse de la paroi bactérienne. Ce qui devrait permettre au monde scientifique de comprendre ensuite comment la pénicilline agit comme un grain de sable au cours de cette construction.
Dans le contexte de l’époque, où les bactéries ont répondu à l’utilisation massive des antibiotiques par la résistance, l’approche de l’équipe de Jean-Marie Ghyusen ouvre de nouvelles perspectives pour la conception de molécules efficaces contre les bactéries.
Lutter contre la résistance bactérienne
« Dans les années 1968-69, l’équipe de Jean-Marie Ghuysen pense avoir identifié deux enzymes impliquées dans la construction de la paroi bactérienne mais une se montrait sensible à la pénicilline et l’autre pas », explique Jean-Marie Frère. Pensant avoir mis le doigts sur un mécanisme de résistance à la pénicilline, Jean-Marie Ghuysen décide d’étudier cela de plus près et de voir comment ces enzymes interagissent concrètement avec la pénicilline. L’idée derrière cette démarche était de trouver de nouvelles molécules capables d’interférer avec l’enzyme qui se montrait résistante à la pénicilline afin de l’empêcher de jouer son rôle dans la formation de la paroi bactérienne. « C’est à ce moment-là que j’ai rejoint l’équipe de Jean-Marie Ghuysen, après avoir effectué un doctorat au Canada et un post-doctorat aux USA sur les enzymes », indique Jean-Marie Frère. « Il s’est avéré par la suite que les deux enzymes identifiées n’avaient en réalité rien à voir l’une avec l’autre et ne représentaient donc pas une version résistante et non résistante à la pénicilline », précise Jean-Marie Frère. La recherche c’est aussi essayer et se tromper, toutes les pistes ne mènent pas à de grandes découvertes. Il faut cependant souligner le fait que l’intuition de départ était correcte. « Plus tard, on a montré que certaines souches résistantes (dont l’infâme Staphylococcus aureus résistant à la méthicilline aussi appelé SARM) devaient cette résistance à l’acquisition d’un gène codant pour une protéine modifiée que la pénicilline inactive très lentement, malgré une similitude structurale incontestable avec les enzymes sensibles. Cela dit, par la suite, plusieurs autres « premières mondiales » ont été réalisée au sein du laboratoire de Jean-Marie Ghuysen. Nous avons montré que les enzymes sensibles à la pénicilline s’attachent à celle-ci via un résidu de sérine », indique Jean-Marie Frère. « Notre équipe a également proposé tout un chemin réactionnel du mécanisme d’action de la pénicilline. Et nous avons obtenu les premiers résultats sur la structure tridimensionnelle d’une enzyme sensible à la pénicilline », précise le scientifique. « Enfin, l’équipe de Jean-Marie Ghuysen a également déterminé la structure d’enzymes qui n’étaient pas sensibles à la pénicilline et qui fonctionnaient selon un mécanisme différent de celui des enzymes pouvant être inhibées par la pénicilline ».
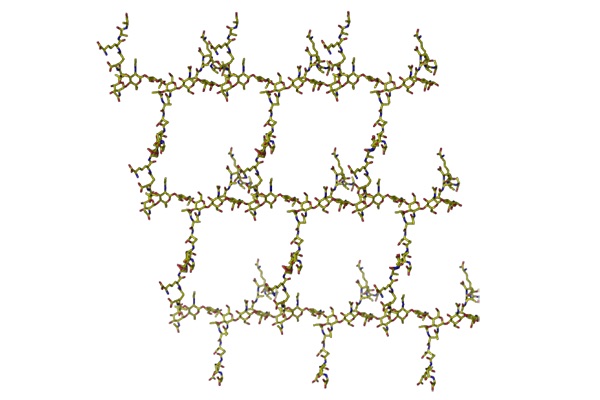
Structure du peptidoglycane
Une certaine clairvoyance…. ou une clairvoyance certaine ?En 1969, juste au moment où Jean-Marie Ghuysen commence à s’intéresser à la résistance à la pénicilline, le plus haut fonctionnaire du Ministère de la Santé aux USA (le « Surgeon General ») déclarait : « Le temps est venu de fermer le livre des maladies infectieuses, de déclarer que cette guerre a été gagnée et de déplacer les ressources nationales vers la lutte contre des maladies chroniques comme le cancer et les maladies cardiaques ». Et il ne fut que trop bien entendu ! Pour la période 2010-2014, le NIH a consacré 15 fois plus d’argent à la recherche sur le cancer qu’à l’étude la résistance aux antibiotiques et aux moyens de la contrer. Il en va de même pour les programmes de l’Union Européenne. Dans ces conditions, il n’est pas étonnant que les compagnies pharmaceutiques aient fortement réduit ou carrément abandonné leurs efforts de recherche dans le domaine des antibiotiques (domaine qui leur avait pourtant rapporté des bénéfices plus que considérables dès 1950). Depuis 1970, les phénomènes de résistance aux composés déjà sur le marché se sont multipliés mais l’introduction de nouvelles molécules, membres de familles connues, a permis de limiter les dégâts. Cependant les sources actuellement exploitées sont en train de se tarir. En 2015, David Cameron (alors Premier Ministre du Royaume Uni) a chargé une Commission de spécialistes (la Commission O’Neill, voir : http://bsac.org.uk/securing-new-drugs-for-future-generations/), d’analyser le problème. Les résultats sont effrayants : en absence d’innovations importantes, la mortalité due aux bactéries résistantes (10 millions de décès par an) dépasserait, en 2050, la mortalité due au cancer (8,3 millions). Le coût économique cumulé d’ici 2050 s’élèverait à plus de 100.000 milliards de dollars... Depuis son petit pays, Jean-Marie Ghuysen voyait bien plus clair que le « Surgeon General » du pays le plus puissant du monde ! |
Des recherches reconnues à travers le monde
Les travaux du Professeur Jean-Marie Ghuysen ont été reconnus de manière universelle et lui ont valu de prestigieuses distinctions. Il a été Président de nombreux symposia dans des conférences internationales et également un conférencier très recherché dans de nombreuses universités de par le monde et lors de nombreux meetings. Il s’est vu décerner le diplôme de Docteur honoris causa des universités de Nancy, Debrecen et Montréal. « Jean-Marie laisse derrière lui un centre prospère, comprenant plus de septante scientifiques et techniciens. Il a laissé une empreinte durable dans le domaine de la science belge et internationale et ses nombreuses publications (plus de trois cent cinquante) resteront longtemps dans la mémoire non seulement des scientifiques à travers le monde mais aussi dans la mémoire de ses trois enfants et de ses huit petits-enfants dont un est … pharmacien ! », écrit Jean-Marie Frère dans son éloge académique pour Jean-Marie Ghuysen à l’Académie Royale de Belgique.
Un texte rédigé par Audrey Binet
Référence scientifique
(1) Jack L. Strominger & Jean-Marie Ghuysen. Mechanisms of Enzymatic Bacteriolysis. Cell walls of bacteri are solubilized by action of either specific carbohydrases or specific peptidases. Science 14 Apr 1967:Vol. 156, Issue 3772, pp. 213-221 DOI: 10.1126/science.156.3772.213

Jean-Marie Ghuysen
En 1947, Jean-Marie Ghuysen est promu pharmacien et, en 1951, il obtient un Doctorat en chimie. Il est engagé au sein du tout récent Département de Microbiologie de l’Université de Liège par le Professeur Maurice Welsch. A cette époque, la découverte de la pénicilline et le concept d’“antibiose” bouleversent la pratique médicale. Le jeune chimiste s’engage dans cette voie et y prend une part décisive. Il travailla ensuite comme Chef des laboratoires de biochimie et de microbiologie à la Société pharmaceutique Labaz (1957-1958) avant de revenir à l’Université de Liège. Plusieurs années lui seront nécessaires pour isoler, à partir de l’actinomycétine (un complexe d’enzymes que sécrète un organisme présent dans tous les sols), une série d’agents qui ont l’étonnante propriété de dissoudre des bactéries vivantes. Grâce à ces observations, il va élucider pas à pas la structure chimique de la paroi bactérienne. Ses travaux lui ont valu de prestigieuses distinctions telles que le Prix Joseph Maisin du FNRS, le Prix de l’Innovation Technologique de la Région wallonne (partagé avec quatre de ses collaborateurs), le Prix international de la Fondation Gairdner en Sciences médicales, le Prix Carlos J. Finlay de l’UNESCO en Microbiologie, le Prix Albert Einstein et le Prix Bristol-Myers Squibb. Il a été Président de nombreux symposia dans des conférences internationales et également un conférencier très recherché dans de nombreuses universités belges et étrangères et lors de nombreux meetings. Il s’est vu décerner le diplôme de Docteur honoris causa des universités de Nancy, Debrecen et Montréal. Nommé Professeur titulaire à l’Université de Liège en 1969, il fut Chercheur attaché des Universités de Manchester, Californie, Washington et Professeur associé des Universités de New York, du Vénézuela (Los Andes), d'Espagne (Alcola de Henares) et de Philadelphie.
Consulter la liste des publications de Jean-Marie Ghuysen sur ORBi (Open Repository and Bibliography).
Consultez la biographie complète

Jean-Marie Frère
Jean-Marie Frère décroche son doctorat en 1969 avec une thèse sur les transmetteurs nerveux, puis accomplit une année de post-doc au MIT à Boston. C’est là qu’il tombe amoureux des enzymes en travaillant sur un enzyme impliqué dans la synthèse des bases de l’ADN. Il rentre ensuite à Liège où il rencontre le professeur Jean-Marie Ghuysen qui était à la recherche de «quelqu’un qui s’y connaissait un peu dans les enzymes». Celui-ci avait en effet isolé deux enzymes que l’on croyait très semblables, dont l’un résistait à la pénicilline et l’autre pas. A Jean-Marie Frère d’expliquer cette différence de comportement. Les débuts d’une collaboration et d’un travail d’équipe qui ne cesseront qu’avec la disparition de Jean-Marie Ghuysen.
Devenu Chargé de cours en 1979, Jean-Marie Frère va s ‘investir dans la toute jeune licence en biochimie. Les cours qu’il y dispense lui permettent de repérer beaucoup de jeunes talents qui viendront grossir les rangs du laboratoire. Nommé professeur ordinaire en 1989, il succède à Jean-Marie Ghuysen à la tête du Centre d’Ingénierie des Protéines (CIP) de l’Université de Liège en 1995. Des fonctions qui ne l’ont jamais empêché de continuer ses recherches : «je suis un vrai fondamentaliste : dès que j’ai une molécule d’enzyme et une de substrat, je suis heureux». Il a été nommé professeur émérite en 2008.
Consulter la liste des publications de Jean-Marie Frère sur ORBi (Open Repository and Bibliography).
